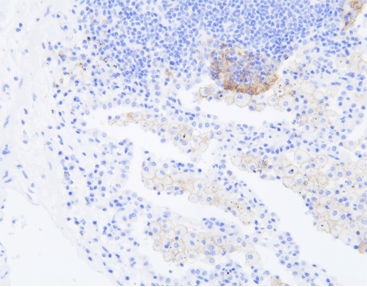
La importancia de la detección de la expresión PD-L1
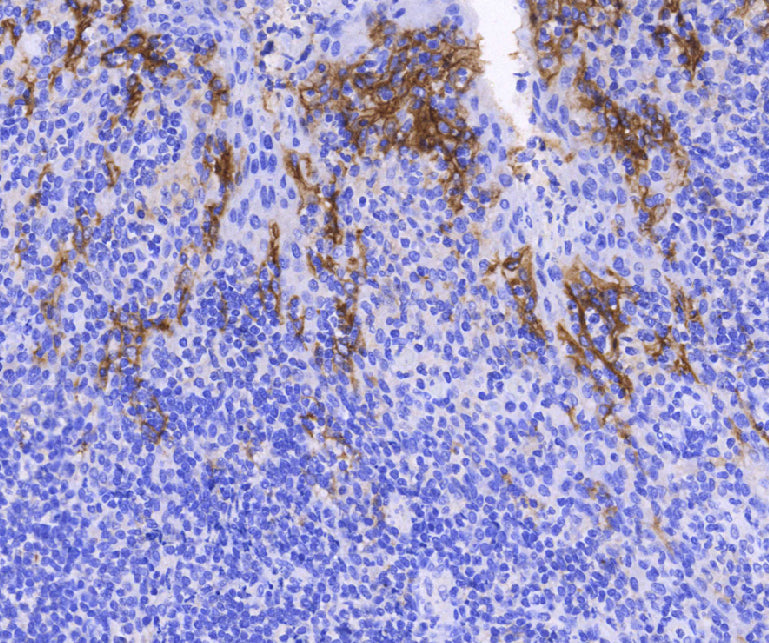
El ligando de muerte programada 1 (PD-L1, también conocido como B7-H1) es un ligando para PD-1 y pertenece a la superfamilia B7. Desempeña un papel en la regulación negativa de las respuestas inmunes. PD-L1 puede expresarse mediante células T, células B, macrófagos y células dendríticas. Se expresa en varios tipos de tumores, incluidos melanoma, cáncer de ovario, cáncer de colon, cáncer de pulmón, cáncer de mama y carcinoma de células renales. Los estudios han demostrado que la vía PD-1/PD-L1 se considera una molécula clave que media el escape inmunológico en el microambiente tumoral. El bloqueo de esta vía puede aliviar la inhibición de las células tumorales en los linfocitos T y mejorar la capacidad del sistema inmunológico para reconocer y eliminar tumores. Por tanto, la expresión de PD-L1 en la superficie de las células tumorales es un biomarcador predictivo importante para la eficacia de la inmunoterapia anti-PD-1/PD-L1.
Actualmente, se han aprobado varios fármacos de inmunoterapia anti-PD-1/PD-L1 para uso clínico, y la Administración Nacional de Productos Médicos (NMPA) y la Administración de Alimentos y Medicamentos de EE. UU. (FDA) han aprobado la detección de la expresión de la proteína PD-L1. , la Agencia Europea de Medicamentos (EMA) y varias directrices a nivel mundial como biomarcador para inmunoterapias contra múltiples tumores. Se utiliza para guiar la selección de pacientes para inmunoterapia y predecir la eficacia de la inmunoterapia.
Sus tindores IHC de CNT 300, CNT 330 y CNT 360 pueden facilitar la detección de PD-L1.
Tipos de muestra de Detección PD-L1
Los tipos de muestras recomendados para las pruebas de inmunohistoquímica de PD-L1 actualmente incluyen muestras histológicas y algunas muestras citológicas (como líquido pleural, ascitis, etc.). El control de calidad generalmente requiere un mínimo de 100 células tumorales en la muestra. El “Consenso de expertos sobre la detección inmunohistoquímica de PD-L1 en tumores sólidos (edición 2021)” y el “Consenso de expertos chinos sobre la detección de la expresión de PD-L1 en cáncer de pulmón de células no pequeñas (edición 2020)” resumen los tipos de muestras que pueden ser probado para PD-L1:
- Se recomienda priorizar las pruebas de inmunohistoquímica de PD-L1 en secciones de tejido tumoral de muestras incluidas en parafina, asegurando una cantidad adecuada de células tumorales para la evaluación. Los estudios han demostrado una alta consistencia (94%) en las tasas de expresión de PD-L1 entre múltiples bloques de tejido del mismo tumor en pacientes con cáncer de pulmón.
- La prueba PD-L1 se puede realizar tanto en muestras de resección quirúrgica como en muestras de biopsia. Si no se dispone de muestras de tejido, se pueden incluir muestras citológicas, como líquido pleural o ascítico, en bloques de parafina para su análisis.
- Para la prueba de PD-L1 se pueden utilizar tanto lesiones primarias como metastásicas. Como puede haber diferencias en la expresión de PD-L1 entre las lesiones primarias y metastásicas, se recomienda realizar pruebas de PD-L1 por separado en ambos tipos de lesiones si es necesario para aclarar el estado de expresión de PD-L1.
- Debido a la heterogeneidad temporal y la influencia del tratamiento en la expresión de PD-L1, se recomienda realizar pruebas de PD-L1 en el momento del diagnóstico inicial y antes de cambiar los planes de tratamiento.
- No se recomienda la prueba inmunohistoquímica de PD-L1 en muestras descalcificadas.
Desafíos en la detección de PD-L1
Plataformas de detección:
Diferentes anticuerpos requieren el uso de diferentes plataformas de detección.
Heterogeneidad espacial y temporal:
La expresión de PD-L1 puede variar en diferentes ubicaciones dentro del mismo tumor y la expresión también puede diferir entre lesiones primarias y metastásicas. Esta heterogeneidad espacial significa que diferentes sitios de biopsia pueden producir diferentes resultados de detección de expresión de PD-L1. Además, los niveles de expresión de PD-L1 pueden cambiar dinámicamente a lo largo del curso de la enfermedad, como con el uso de inmunoterapia, radioterapia, quimioterapia, terapia antiangiogénica, etc.
Interpretación de resultados:
Los diferentes anticuerpos tienen diferentes criterios de interpretación para los resultados de su detección. Los métodos de interpretación también pueden variar para el mismo anticuerpo en diferentes tipos de tumores. Diferentes empresas utilizan diferentes anticuerpos para las pruebas de PD-L1 y cada anticuerpo tiene su propio índice de referencia o criterio de umbral. En los tejidos tumorales, además de las células cancerosas, también hay células estromales (como células inmunitarias, células endoteliales, fibroblastos, etc.) que los rodean. Por lo tanto, al teñir una muestra de tejido tumoral, las células teñidas pueden incluir tanto células cancerosas como otras células. Los métodos de determinación utilizados para la prueba de anticuerpos PD-L1 incluyen la puntuación de proporción tumoral (TPS), la puntuación positiva combinada (CPS) y el cálculo separado de las células tumorales (TC) y las células inmunes (IC).
Estos desafíos resaltan la complejidad y variabilidad en la detección de PD-L1, lo que requiere una cuidadosa consideración y estandarización de los protocolos de prueba y los criterios de interpretación para garantizar resultados precisos y confiables.
Reactivos de prueba de inmunohistoquímica PD-L1
Actualmente, existen seis anticuerpos de diagnóstico complementarios PD-L1 aprobados por la Administración Nacional de Productos Médicos (NMPA) en China. Estos incluyen 22C3 y 28-8 de DAKO, SP142 y SP263 de Roche, WD160 de Wondfo y E1L3N de AmoyDx. Con sus ventajas de rentabilidad y resultados de pruebas consistentes, los productos de anticuerpos PD-L1 producidos en el país están ganando popularidad en el mercado.
PD-L1 (Clon: E1L3N )
E1L3N, el primer producto de diagnóstico complementario PD-L1 producido en el país, se utiliza como diagnóstico complementario para los medicamentos de inmunoterapia de renombre internacional pembrolizumab (nombre comercial: Keytruda) y nivolumab (nombre comercial: Opdivo) en el tratamiento del cáncer de pulmón de células no pequeñas. . Los estudios internacionales han demostrado una buena coherencia entre el clon E1L3N y los anticuerpos 22C3, 28-8 y SP263 en la detección de la expresión de PD-L1 en células tumorales. El patrón de tinción y la intensidad son similares a SP263 y tiene mejor sensibilidad que el clon SP142, especialmente en casos de baja expresión de PD-L1.
La adaptabilidad de la plataforma es otra ventaja de E1L3N. Se puede utilizar en múltiples plataformas de detección, ya que ha sido ampliamente validado en la plataforma Celnovte con buena consistencia. Esto facilita el uso generalizado de la prueba PD-L1 en hospitales, beneficiando a un gran número de pacientes con cáncer.
E1L3N, como reactivo representativo de producción nacional para diagnósticos complementarios de inmunoterapia, recibió una recomendación prioritaria en el Consenso de expertos chinos sobre la detección de la expresión de PD-L1 en el cáncer de pulmón de células no pequeñas (edición de 2023).
PD-L1 Detección S oluciones de Celnovte
celnovte Biotech , fundada en 2010, es una empresa de alta tecnología que se especializa en la investigación, desarrollo, producción y venta de instrumentos de diagnóstico de precisión y reactivos para tumores. Con un fuerte enfoque en la calidad y la innovación, la empresa ha establecido un sistema integral que cumple con los requisitos GMP, incluida la producción, el control de calidad y la investigación y el desarrollo. Celnovte Biotech cuenta con talleres de producción limpia y equipos de última generación, asegurando los más altos estándares en sus productos. La empresa ha obtenido las certificaciones ISO9001, ISO13485 y EU CE-ID, posicionándose como líder en la industria. Guiada por su filosofía empresarial de calidad, innovación y servicio, Celnovte Biotech se dedica a brindar productos y servicios de primer nivel a sus usuarios. Su objetivo es convertirse en una empresa de innovación tecnológica de referencia en la industria, contribuyendo a los avances científicos y tecnológicos en el campo de las ciencias de la vida y la medicina. Centrándose en la detección temprana, el diagnóstico preciso, el acompañamiento farmacológico y el seguimiento del tratamiento de tumores, Celnovte Biotech se esfuerza por construir una cadena industrial completa, integrando investigación y desarrollo, producción, ventas y servicio. Su objetivo es convertirse en un proveedor líder de soluciones integrales en productos de diagnóstico de patología tumoral, tanto a nivel nacional como internacional.

El Centro de I+D de anticuerpos Celnovte proporciona una solución completa de detección de PD-L1, que incluye reactivos de anticuerpos PD-L1 (clon: E1L3N), sistemas de detección de anticuerpos secundarios y plataformas de tinción inmunohistoquímica, que respaldan los diagnósticos complementarios de la inmunoterapia. Sus tindores IHC de CNT300 , CNT330 , y CNT360 son soluciones eficientes para la detección y diagnóstico.